Ta kontroll över din hälsa - PROSTATA och PSA-värde
Prostatacancer är en tumörsjukdom som uppstår i prostatan. Sjukdomen drabbar cirka
10 000 män per år och är Sveriges vanligaste cancerform. Det blir allt vanligare att
män över 50 år får problem med prostatasjukdomar. Många får förstorad prostata eller
till och med utvecklar en långsamt stegrande prostatacancer.
Symtom på prostatacancer
Prostatacancer ger i ett tidigt stadium ofta inga symtom alls.
Sjukdomen kan emellertid orsaka dessa problem:
Behovet av att urinera ofta
Svårigheter att få igång urineringen eller att hålla tillbaka urinen
Oförmåga att urinera
Smärtsam eller brännande urinering
Svårighet att få erektion
Smärtsamma ejakulationer
Blod i urinen eller sädesvätska
Återkommande smärtor eller stelhet i längdrygg, höfter eller i lårens överdel
Vart och ett av dessa behöver inte vara prostatacancer men du bör söka läkare om du
har någon av ovanstående symtom.
Fakta
Om PSA-värdet är högre än normalt tyder det på sjukdom i prostatakörteln.
Förhöjda PSA-värden behöver dock inte innebära att man har cancer utan det kan
också vara tecken på godartad prostataförstoring eller en infektion i prostatakörteln
eller urinvägarna.
Prognosen för den som drabbas av prostatacancer är tack vare nya kunskaper och
behandlingsmetoder god.
Det finns flera olika sätt att behandla prostatacancer på, bland annat genom
operation, strålbehandling, cellgiftsbehandling eller hormonbehandling.
Senare forskning har också visat att naturliga polyfenoler, som är en sorts antioxidant,
har god effekt på prostatacancer.
Enskilda polyfenolrika livsmedel såsom granatäpple, grönt te, gurkmeja och broccoli
har tumörhämmande egenskaper och har bekräftats av olika studier.
I olika studier har man sett ett samband mellan mjölk och ökad risk för prostataproblem
pga kalciumöverskott som kan hämma ämnesomsättningen.
Här kan du b la. läsa mer om detta.
För att förebygga och upptäcka prostatacancer i tid är en av de bästa verktygen
vävnadsanalys där Hårmineralanalys är en enkel metod för att upptäcka brister
och/eller obalans mellan olika mineralämnen och metaller som i många studier
visat sig ha en stor roll och samband. Man har sett att Järn, Zink, Koppar, Krom
och Selen b.la har en inverkan och genom att ta reda på dess värden och upptag
i kroppen kan man genom rätt kost och näring både förebygga och motverka uppkomsten
av problemen.
Det är dock viktigt att inte på måfå häva i sig olika näringsämnen utan att veta exakt
vad du behöver eftersom balansen på mineralämnen är viktiga.
Exempel på indikationer som kan tyda på zinkbrist
Nedsatt immunförsvar
Zink är nödvändigt för immunförsvarets normala funktion och behövs för kroppens läkning
och förmåga att motstå infektioner. Om du ofta blir sjuk med envisa förkylningar så kan det
vara värt att kolla dina zinkvärden.
Synliga besvär på hud, hår och naglar
Att vi får i oss tillräckligt med av zink är nödvändigt för att hår, hud och naglar ska må bra.
Eftersom ca 20 procent av all zink i kroppen återfinns i huden som snabbt reagerar på brist, är hudförändringar en vanlig bristsymtom. Försämrad hudläkning och hudproblem som eksem, akne, bölder, rosacea och psoriasis, hudsprickor och hudbristningar vid graviditet kan vara tecken på zinkbrist. Spröda naglar och vita fläckar samt håravfall kan vara andra indikationer.
Krånglande mage
Zink fungerar som en cofaktor i fler än 40 viktiga enzymreaktioner, många inblandade i matsmältningen. Så vid brist kan kroppen ha svårare att smälta maten ordentligt och ta upp näringen. Magknip, orolig mage, illamående, kräkningar och diarré kan därmed vara indikationer
för att zinknivåerna är låga.
Försämrad kognitiv funktion
Zink bidrar till normal kognitiv funktion och påverkar hur vi kan ta emot, bearbeta och förmedla information. Bra zinknivåer har därför en stor betydelse för våra hjärnfunktioner som är involverade i minne och tankeprocesser. En välfungerande kognitiv funktion behövs även för att vi ska kunna skapa ordning och begriplighet i vår tillvaro.
Sexuella och infertila problem
Zink bidrar till normal fertilitet och reproduktion hos både kvinnor och män. Hos män är tillräckliga nivåer av zink är nödvändigt för normala testosteronnivåer i blodet, för en frisk prostata och för produktionen av spermier och sädesvätska. Zinkbrist kan förknippats med impotens, infertilitet problem, utebliven produktion av spermier och förstorad prostata. Hos kvinnor kan zinkbrist leda till utebliven ägglossning och missfall.
Nedsatt synförmåga
Zink behövs för att vår synförmågan ska fungera normalt. Man kan därför uppleva synförändringar som försämrat mörkerseende och nedsatt synförmåga vid zinkbrist. Långvarig och allvarlig brist kan leda till ett ögonsjukdomar, som t.ex. starr och makula degeneration.
Ihållande träningsvärk
Vid hård träning och när man svettas ökar utsöndringen av zink, vilket gör att behovet ökar. Kroppen behöver även zink för att kunna återhämta sig efter träning. Om träningsvärken håller i sig i flera dagar så kan det vara en antydan till att zinknivåerna i kroppen är låga.
Ett bra kosttillskott som rekommenderas är Granatin Man som innehåller naturliga polyfenoler.
Du kan beställa dessa här
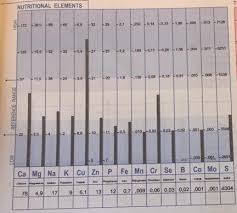
Här beställer du hem ett testkit för att göra en Hårmineralanalys.På bilden kan du se hur det kan se ut om man har zinkbrist i förhållande till koppar och även överskott av kalcium som kan ha en koppling med prostatproblem.
källa: prostatacancerförbundet, https://www.nature.com/articles/pcan20146, https://link.springer.com/article/10.1007/s12011-014-0123-4
1 Clark LC, Combs GF Jr, Turnbull BW et al. for the Nutritional Prevention of Cancer Study Group. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. JAMA 1996; 276: 1957 – 63
CrossrefCASPubMedWeb of Science®Google Scholar
2 Clark LC, Dalkin B, Krongrad A et al. Decreased incidence of prostate cancer with selenium supplementation: results of a double‐blind cancer prevention trial. Br J Urol 1998; 81: 730 – 4
Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
3 Hoedemaeker RF, Vis AN, Van Der Kwast TH. Staging prostate cancer. Microsc Res Tech 2000; 51: 423 – 9
Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
4 Catalona WJ, Richie JP, Ahmann FR et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol 1994; 151: 1283 – 90
CrossrefPubMedWeb of Science®Google Scholar
5 Schroder FH, Van Der Maas P, Beemsterboer P et al. Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 1998; 90: 1817 – 23
CrossrefCASPubMedWeb of Science®Google Scholar
6 Maattanen L, Auvinen A, Stenman UH et al. European randomized study of prostate cancer screening: first‐year results of the Finnish trial. Br J Cancer 1999; 79: 1210 – 4
CrossrefCASPubMedWeb of Science®Google Scholar
7 Brooks JD, Metter EJ, Chan DW et al. Plasma selenium level before diagnosis and the risk of prostate cancer development. J Urol 2001; 166: 2034 – 8
CrossrefCASPubMedWeb of Science®Google Scholar
8 Yoshizawa K, Willett WC, Morris SJ et al. Study of prediagnostic selenium level in toenails and the risk of advanced prostate cancer. J Natl Cancer Inst 1998; 90: 1219 – 24
CrossrefCASPubMedWeb of Science®Google Scholar
9 Nomura AM, Lee J, Stemmermann GN, Combs GF Jr. Serum selenium and subsequent risk of prostate cancer. Cancer Epidemiol Biomarkers Prev 2000; 9: 883 – 7
CASPubMedWeb of Science®Google Scholar
10 West DW, Slattery ML, Robison LM, French TK, Mahoney AW. Adult dietary intake and prostate cancer risk in Utah: a case‐control study with special emphasis on aggressive tumors. Cancer Causes Control 1991; 2: 85 – 94
CrossrefPubMedWeb of Science®Google Scholar
11 Willett WC, Polk BF, Morris JS et al. Prediagnostic serum selenium and risk of cancer. Lancet 1983; 2: 130 – 4
CrossrefPubMedWeb of Science®Google Scholar
12 Coates RJ, Weiss NS, Daling JR, Morris JS, Labbe RF. Serum levels of selenium and retinol and the subsequent risk of cancer. Am J Epidemiol 1988; 128: 515 – 23
CrossrefPubMedWeb of Science®Google Scholar
13 Helzlsouer KJ, Huang HY, Alberg AJ et al. Association between alpha‐tocopherol, gamma‐tocopherol, selenium, and subsequent prostate cancer. J Natl Cancer Inst 2000; 92: 2018 – 23
CrossrefCASPubMedWeb of Science®Google Scholar
14 Webber MM, Perez‐Ripoll EA, James GT. Inhibitory effects of selenium on the growth of DU‐145 human prostate carcinoma cells in vitro. Biochem Biophys Res Commun 1985; 130: 603 – 9
CrossrefCASPubMedWeb of Science®Google Scholar
15 Menter DG, Sabichi AL, Lippman SM. Selenium effects on prostate cell growth. Cancer Epidemiol Biomarkers Prev 2000; 9: 1171 – 82
CASPubMedWeb of Science®Google Scholar
16 Jiang C, Wang Z, Ganther H, Lu J. Caspases as key executors of methyl selenium‐induced apoptosis (anoikis) of DU‐145 prostate cancer cells. Cancer Res 2001; 61: 3062 – 70
CASPubMedWeb of Science®Google Scholar
17 Kumaraswamy E, Malykh A, Korotkov KV et al. Structure‐Expression Relationships of the 15‐kDa Selenoprotein Gene. Possible role of the protein in cancer etiology. J Biol Chem 2000; 275: 35540 – 7
CrossrefCASPubMedWeb of Science®Google Scholar
18 Moul JW. Prostate‐specific antigen‐enhanced testing and risk stratification for chemoprevention trials. Urology 2001; 57: 174 – 7
CrossrefCASPubMedWeb of Science®Google Scholar
19 Cook NR, Stampfer MJ, Ma J et al. Beta‐carotene supplementation for patients with low baseline levels and decreased risks of total and prostate carcinoma. Cancer 1999; 86: 1783 – 92
Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
20 Colditz GA. Selenium and cancer prevention. Promising results indicate further trials required. JAMA 1996; 276: 1984 – 5
CrossrefPubMedWeb of Science®Google Scholar
21 Clark LC, Marshall JR. Randomized, controlled chemoprevention trials in populations at very high risk for prostate cancer. Elevated prostate‐specific antigen and high‐grade prostatic intraepithelial neoplasia. Urology 2001; 57: 185 – 7
CrossrefCASPubMedWeb of Science®Google Scholar
22 Klein EA, Thompson IM, Lippman SM et al. SELECT. The next prostate cancer prevention trial. J Urol 2001; 166: 1311 – 5
CrossrefCASPubMedWeb of Science®Google Scholar
Adaramoye OA, Akinloye O, Olatunji IK, (2010). Trace elements and vitamin E status in Nigerian patients with prostate cancer. Afr Health Sci, 10, 2-8.
Bae YJ, Yeon JY, Sung CJ, Kim HS, Sung MK, (2009). Dietary intake and serum levels of iron in relation to oxidative stress in breast cancer patients. J Clin Biochem Nutr, 45, 355-60. https://doi.org/10.3164/jcbn.09-46
Banas A, Kwiatek WM, Banas K, et al (2010). Correlation of concentrations of selected trace elements with gleason grade of prostate tissues. J Biol Inorg Chem, 15, 1147-55. https://doi.org/10.1007/s00775-010-0675-5
Brooks JD, Metter EJ, Chan DW (2001). Plasma selenium level before diagnosis and the risk of prostate cancer development. J Urol, 166, 2034-8. https://doi.org/10.1016/S0022-5347(05)65500-0
Chan AT, Ma J, Tranah GJ, et al (2005). Hemochoromotasis gene, mutation, body iron stores,dietary irons, and risk of colorectal adenoma in women. J Natl Cancer Inst, 15, 917-26.
Chatt A, Katz SA (1988). The biological basis for trace elements in hair. Hair analysis.Biomedicaland.Environmental Sciences (VCH publishers, New York).
Choi J, Neuhouser M, Barnett M, et al (2008). Iron intake, oxidative stress-related genes (MnSOD and MPO) and prostate cancer risk in CARET cohort. Carcinogenesis, 29, 964-70. https://doi.org/10.1093/carcin/bgn056
Chua C, Morgan H (1996). Effects of iron deficiency and iron overload on manganese uptake and deposition in the brain and other organs of the rat. Biol Trace Element Res, 55, 39-54. https://doi.org/10.1007/BF02784167
Costello LC, Franklin RB (2011). Zinc is decreased in prostate cancer: an established relationship of prostate cancer. J Biol Inorg Chem, 16, 3-8. https://doi.org/10.1007/s00775-010-0736-9
Dunna BK, Richmonda ES, Minasiana LM, Ryana AM, Forda LG (2011). A nutrient approach to prostate cancer prevention: The selenium and vitamin E cancer prevention trial (SELECT). Nutr Cancer, 62, 896-918.
Epstein MM, Kasperzyk JL, Andren O, et al (2011). Dietary zinc and prostate cancer survival in a Swedish cohort. Am J Clin Nutr, 93, 586-93. https://doi.org/10.3945/ajcn.110.004804
Gammelgaard B, Peters K, Menne T (1991). Reference values for the nickel concentration in human finger nails. J Trace Elem Electrolytes Health Dis, 5, 121-3.
Gsur A, Feik E, Stephan M (2004). Genetic polymorphisms and prostate cancer risk. World J Urol, 21, 414-23. https://doi.org/10.1007/s00345-003-0378-4
Harris GK, Shi Xianglin (2003). Signaling by carcinogenic metals and metal-induced reactive oxygen species. Mutate Res, 533, 183-200. https://doi.org/10.1016/j.mrfmmm.2003.08.025
Jarup L (2003). Hazards of heavy metal contamination. Br Med Bull, 68, 167-82. https://doi.org/10.1093/bmb/ldg032
Killilea NA, Aydin A, Arsova-Sarafinovska Z, et al (2007). Zinc deficiency reduces paclitaxel efficacy in LNCaP prostate cancer cells. Cancer Lett, 258, 70-9. https://doi.org/10.1016/j.canlet.2007.08.010
Lee DH, Jacobs DRJ (2005). Interaction among heme iron, zinc and supplemental vitamin C intake on the risk of lung cancer. Iowa women's health study. Nutr Cancer, 52 ,130-7. https://doi.org/10.1207/s15327914nc5202_3
Lee JD, Wu SM, Lu LY, Yang YT, Jeng SY (2009). Cadmium concentration and metallothionein expression in prostate cancer and benign prostatic hyperplasia of humans. J Formos Med Assoc, 108, 554-9. https://doi.org/10.1016/S0929-6646(09)60373-9
Mahata J, Basu A, Ghoshal S, et al (2003). Chromosomal aberrations and sister chromatid exchanges in individuals exposed to arsenic through drinking water in West Bengal, India. Mutat Res, 534, 133-43. https://doi.org/10.1016/S1383-5718(02)00255-3
Majumder S, Chatterjee S, Pal S, et al (2009). The role of copper in drug-resistant murine and human tumors. Biometals, 22, 377-84. https://doi.org/10.1007/s10534-008-9174-3
Mehra R, Juneja M (2005). Elements in scalp hair and nails indicating metal body burden in polluted environment. J Sci Ind Res, 64, 119-24.
Ministry of Health. Protocol for collecting height, weight and waist measurements in New zealand health monitor (NZHM) surveys, Wellington: Ministry of Health 2008. Available at: http://www.moh.govt.nz/moh.nsf/pagesmh/7682/$File/ protocols-for-collectingheight-weight-waist-measurements. pdf .
Montazeri A, Vahdaninia M, Ebrahimi M, Jarvandi S (2003). The hospital anxiety and depression scale (HADS): translation and validation study of the Iranian version. Health Qual Life Outcomes, 1, 14. https://doi.org/10.1186/1477-7525-1-14
Muzandu K, Shaban Z, Ishizuka M, Kazusaka A, Fujita S (2005). Nitric oxid enhances catechol estrogen-induced oxidative stress in LNCaP cells. Free Radic Res, 39, 389-98. https://doi.org/10.1080/10715760400029710
Pasha Q, Malik SA, Shah MH (2008). Statistical analysis of trace metals in the plasma of cancer patients versus controls. J Hazard Mater, 153, 1215-21. https://doi.org/10.1016/j.jhazmat.2007.09.115
Reyes HL, Gayon JM, Garcia JI, Sanz-Medel A (2002). Determination of selenium in biological materials by isotope dilution analysis with an octapole reaction system ICP-MS. JAAS, 18, 11-6.
Sapota A, Darago' A, Taczalski J, Kilanowicz A (2009). Disturbed homeostasis of zinc and other essential elements in the prostate gland dependent on the character of pathological lesions. Biometals, 22, 1041-9. https://doi.org/10.1007/s10534-009-9255-y
Shahar S, Shafurah S, Abu Hasnan Shaari NS, et al (2011). Roles of dietary, lifetime physical activity and oxidative DNA damage in the occurrence of prostate cancer among men in Klang Valley. Asian Pac J Cancer Prev, 12, 1-6.
Shahar S, Cham BG, Ahmad Rohi G, et al (2009). Relationship between selenium and breast cancer: a case-control study in the Klang Valley. Singapore Med J, 50, 265.
Siah CW, Trinder D, Olynyk JK (2005). Iron overload. Clin Chim Acta, 358, 24-36. https://doi.org/10.1016/j.cccn.2005.02.022
Uauy R, Olivares M, Gonzalez M (1998). Essentiality of copper in humans. Am J Clin Nutr; 67, 952-9.
Vinceti M, Venturelli M, Sighinolfi C, et al (2007). Case-control study of toenail cadmium and prostate cancer risk in Italy. Sci Total Environ, 373, 77-8. https://doi.org/10.1016/j.scitotenv.2006.11.005
Wu Y, Yu Y., Xu G (1988). Clinical study on serum copper, zinc levels and copper/ zinc ratio in malignant lymphoma, Chin J Oncol, 10, 335-7.
Zhao W, Han Z (1998). Relationship of serum trace elements to lung cancer and clinical application. Chin J Epidemiol, 19, 286-90.
Zhou W, Park S, Liu G, et al (2005). Dietary iron, zinc and calcium and the risk of lung cancer. Epidemiology, 16 ,772-9. https://doi.org/10.1097/01.ede.0000181311.11585.59
Cited by
Lack of Association between Fingernail Selenium and Thyroid Cancer Risk: A Case-Control Study in French Polynesia vol.15, pp.13, 2014, https://doi.org/10.7314/APJCP.2014.15.13.5187
Prostate-Specific Antigen Levels in Relation to Background Factors: Are there Links to Endocrine Disrupting Chemicals and AhR Expression? vol.15, pp.15, 2014, https://doi.org/10.7314/APJCP.2014.15.15.6121
Prevention of Prostate Cancer with Vitamins - Current Perspectives vol.15, pp.5, 2014, https://doi.org/10.7314/APJCP.2014.15.5.1897
Serum Levels of Trace Elements in Patients with Prostate Cancer vol.15, pp.6, 2014, https://doi.org/10.7314/APJCP.2014.15.6.2625
Preparation of Selenium-enriched Bifidobacterium Longum and its Effect on Tumor Growth and Immune Function of Tumor-Bearing Mice vol.15, pp.8, 2014, https://doi.org/10.7314/APJCP.2014.15.8.3681
Use of INAA and ICP-MS for the assessment of trace element mass fractions in adult and geriatric prostate vol.301, pp.2, 2014, https://doi.org/10.1007/s10967-014-3173-3
Association between maternal aluminum exposure and the risk of congenital heart defects in offspring vol.106, pp.2, 2015, https://doi.org/10.1002/bdra.23464
Current opinion on the role of testosterone in the development of prostate cancer: a dynamic model vol.15, pp.1, 2015, https://doi.org/10.1186/s12885-015-1833-5
A Correlation Between Diet and Longevity Characterization by Means of Element Profiles in Healthy People over 80 Years from a Chinese Longevous Region vol.165, pp.1, 2015, https://doi.org/10.1007/s12011-015-0233-7
Targeting copper in cancer therapy: ‘Copper That Cancer’ vol.7, pp.11, 2015, https://doi.org/10.1039/C5MT00149H
Classification models based on the level of metals in hair and nails of laryngeal cancer patients: diagnosis support or rather speculation? vol.7, pp.3, 2015, https://doi.org/10.1039/C4MT00285G
Zinc Intake and Risk of Prostate Cancer: Case-Control Study and Meta-Analysis vol.11, pp.11, 2016, https://doi.org/10.1371/journal.pone.0165956
Hypoadiponectinemia, elevated iron and high-sensitivity C-reactive protein levels and their relation with prostate size in benign prostatic hyperplasia vol.49, pp.7, 2016, https://doi.org/10.1111/and.12715
Copper and conquer: copper complexes of di-2-pyridylketone thiosemicarbazones as novel anti-cancer therapeutics vol.8, pp.9, 2016, https://doi.org/10.1039/C6MT00105J
Barium exposure increases the risk of congenital heart defects occurrence in offspring pp.1556-9519, 2017, https://doi.org/10.1080/15563650.2017.1343479
Atomic Emission Analysis of Human Nails for the Content of Trace Elements vol.73, pp.2, 2018, https://doi.org/10.1134/S1061934818020107